天津工生所在合成生物学驱动的肠道益生菌微胶囊递送系统开发研究方面取得新进展
字号:【大】 【中】 【小】
益生菌作为调节肠道菌群稳态的重要功能活菌,在生物医药与功能食品领域应用前景广阔。然而传统液态益生菌制剂存在储存运输稳定性不足、胃酸胆汁耐受能力弱等缺陷,导致口服生物利用度偏低,严重制约其临床转化与产业化应用。
近日,中国科学院天津工业生物技术研究所应用微生物生态工程团队在肠道益生菌精准递送领域取得突破性进展。团队以合成生物学“理性设计、定向构建、精准调控”的核心理念为指导,立足生物底盘优化与载体设计的交叉思路,针对罗伊氏乳杆菌在储存、胃肠转运过程中稳定性差、定殖效率低的关键瓶颈,成功构建缓释型与快释型两种差异化微胶囊控释递送系统,实现目标的精准调控与高效输出。
控释递送载体的理性设计与组装:创新性选用海藻酸钠-壳聚糖复合体系作为包埋载体,利用不同天然高分子材料的理化特性及互作机制,开发可精准调控的复合载体材料。构建出提升包埋效率的缓释模型,优化后包埋率最高达88.64%;和增强胰液响应性崩解能力的快释模型,实现83.3%的高累积释放率。表征结果显示,两种微胶囊均具备光滑致密的表面与多孔内部结构,为益生菌构建高效保护屏障,该设计充分体现了 “结构-功能”精准匹配的理念。
体外模型实验(图1)与动物实验(图2)相结合的功效评价:团队通过体外胃肠液模型与小鼠结肠炎模型,开展系统性评价。实验证实,两种微胶囊均可显著提升罗伊氏乳杆菌的胃肠液耐受能力,4℃低温储存42天活菌数损失率均低于3%,展现出优异的储存稳定性。其中,快释型可迅速响应消化道环境信号,在上消化道实现活菌快速释放,相比缓释型更易完成肠道定殖。
该研究建立全新的益生菌控释靶向递送技术平台。其中,快释型微胶囊适用于急性肠道疾病的快速干预场景,缓释型微胶囊则可满足长效肠道菌群调节的需求。两种模型的差异化设计,为不同临床需求提供精准的解决方案,突破传统益生菌制剂“递送效率低、功能发挥不稳定”的技术瓶颈。该成果为合成生物学在活菌生物治疗产品(LBPs)研发领域的应用提供了重要技术范式,有望推动益生菌制剂在炎症性肠病、急性腹泻等疾病治疗中的应用,为合成生物学与生物医药的融合发展奠定基础。
本研究获得天津市科技计划项目资助,相关研究成果发表于国际食品科学领域双一区期刊npj Science of Food。天津工生所助理研究员徐松为第一作者,韩瑞琴、张志鹏、王敬敬、张小霞为共同作者,黄志勇研究员为通讯作者。
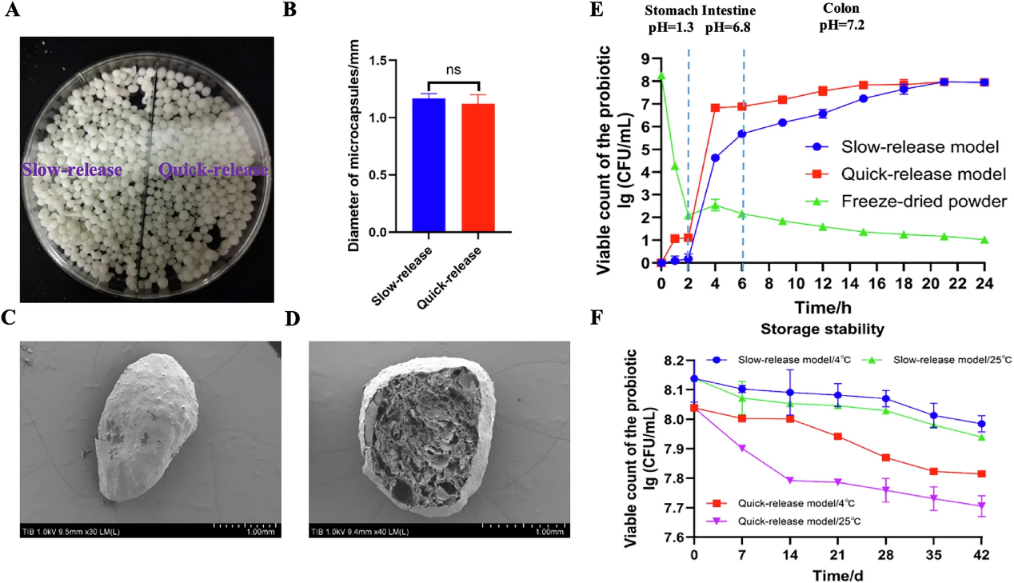
图1 罗伊氏乳杆菌 A-1 微胶囊的表观特征与体外评价
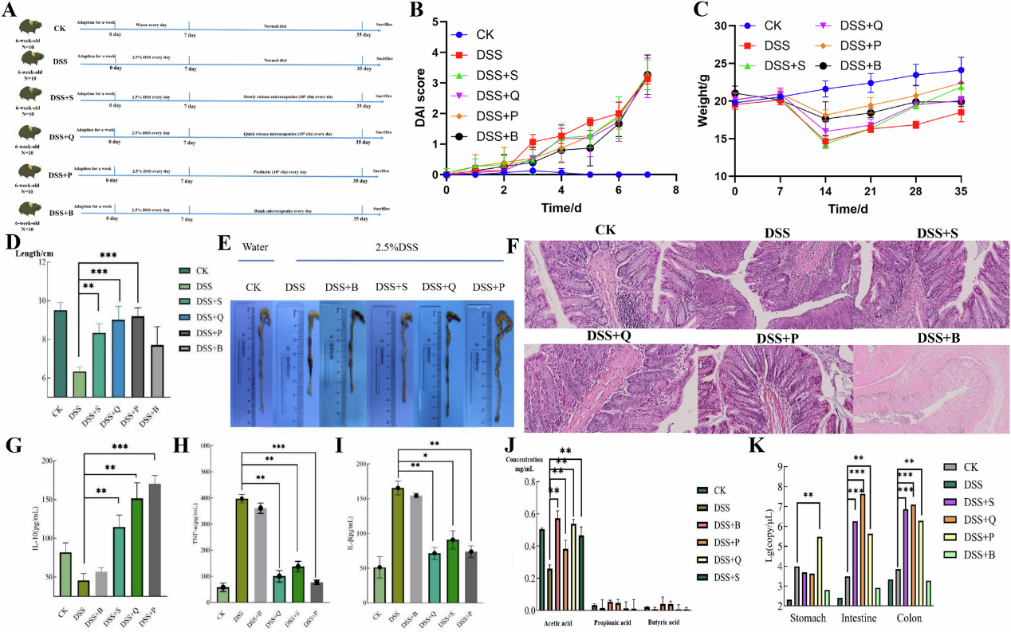
图2 在小鼠肠炎模型中评估了两种不同模型的罗伊氏乳杆菌 A-1 微胶囊的效果
版权所有 © 2012- Copyright All Rights Reserved 中国科学院天津工业生物技术研究所 版权所有
通讯地址:天津空港经济区西七道32号,邮编:300308
电话:022-84861997/84861977,传真:022-84861926,邮箱:tib_zh(AT)tib.cas.cn